Üretim
Yeni jenerasyon
biyoüretim
Bizi tanımlayan şey uyguladığımız süreçlerdir
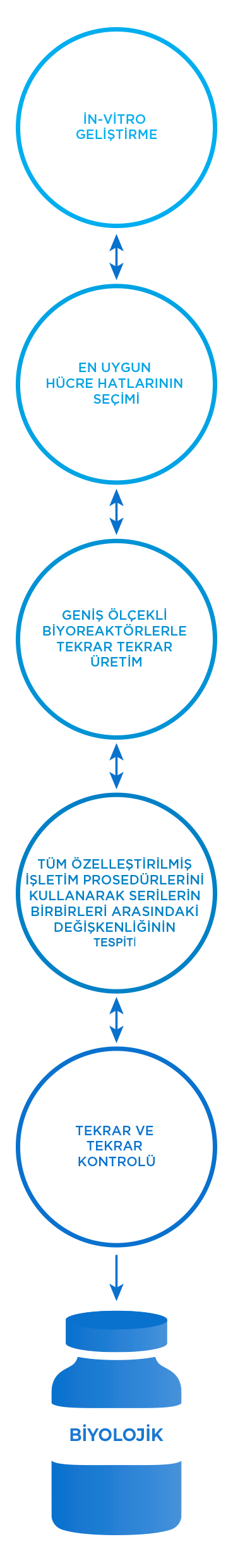
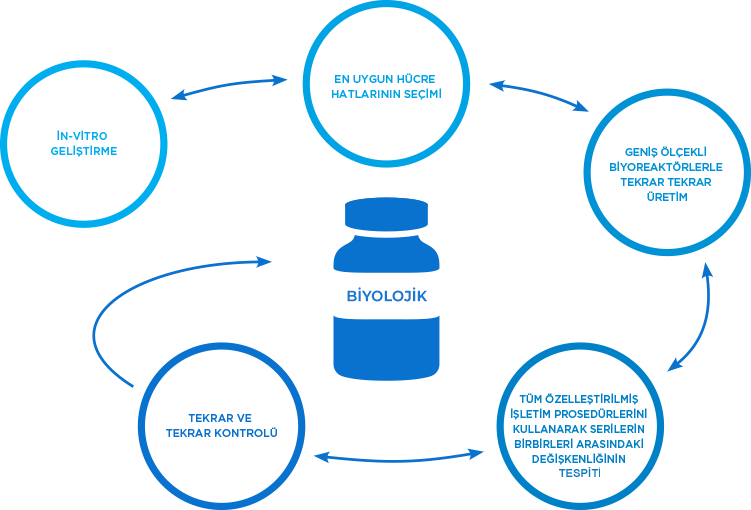
Amgen'da, in vitro monoklonal antikor geliştirme konusunda üst düzey uzmanlık gerektiren yinelemeli süreci kusursuz bir biçimde işletiyoruz; bunu yapabilmek için, en uygun hücre hattını geniş ölçekli biyoreaktörlerle sürekli olarak çoğaltıyor ve serilerin birbirleri ile tutarlılığını tekrar tekrar kontrol ediyoruz.4,5
Biyobenzer Tasarımı
Referans bir biyolojik ürünün kritik kalite özelliklerine bağlı olarak, konak hücre proteinleri, ürün özellikleri, varyantlar, proses safsızlıkları ve stabilite profili bakımından çok benzer bir biyobenzer tasarlanır.
Karakterizasyon ve karşılaştırma çalışmaları
Analitik ve farmakokinetik/farmakodinamik (PK/PD) verilerde referans biyolojik ürün ile biyobenzer arasında yüksek benzerlik olması düşük klinik farklılık riskini gösterir.
Üretimdeki kalite standartları
Kaliteyi artırmak için üretim prosesi boyunca sıkı kalite standartları ve kapsamlı risk değerlendirmeleri.
Canlı hücrelerden doğan ilaçlar
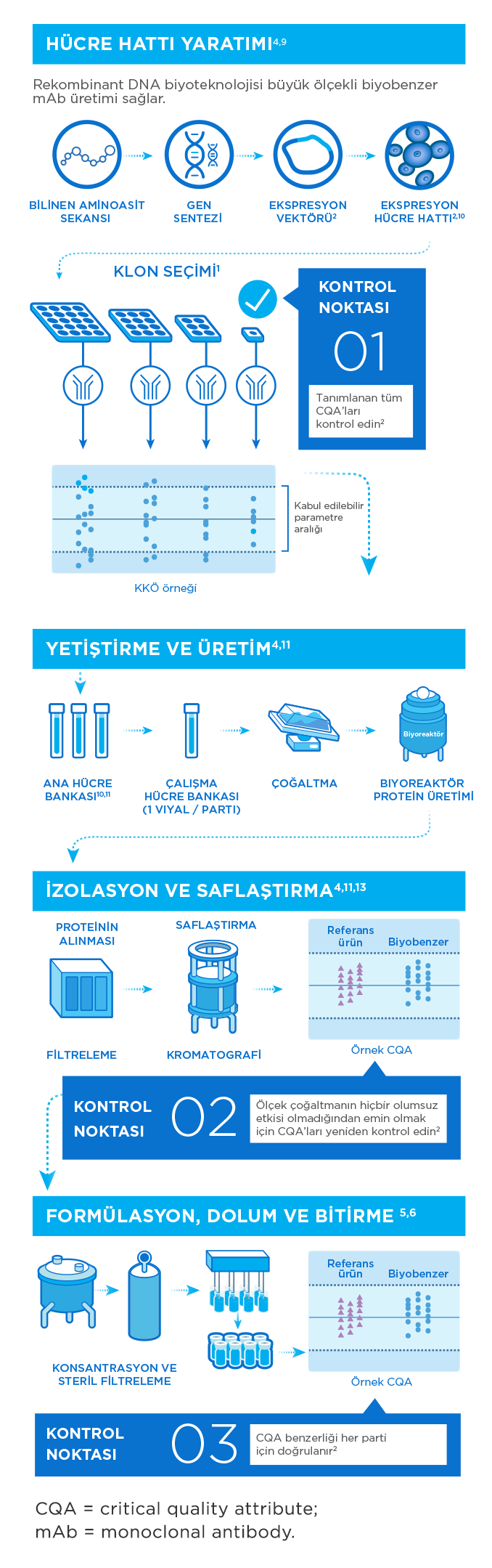
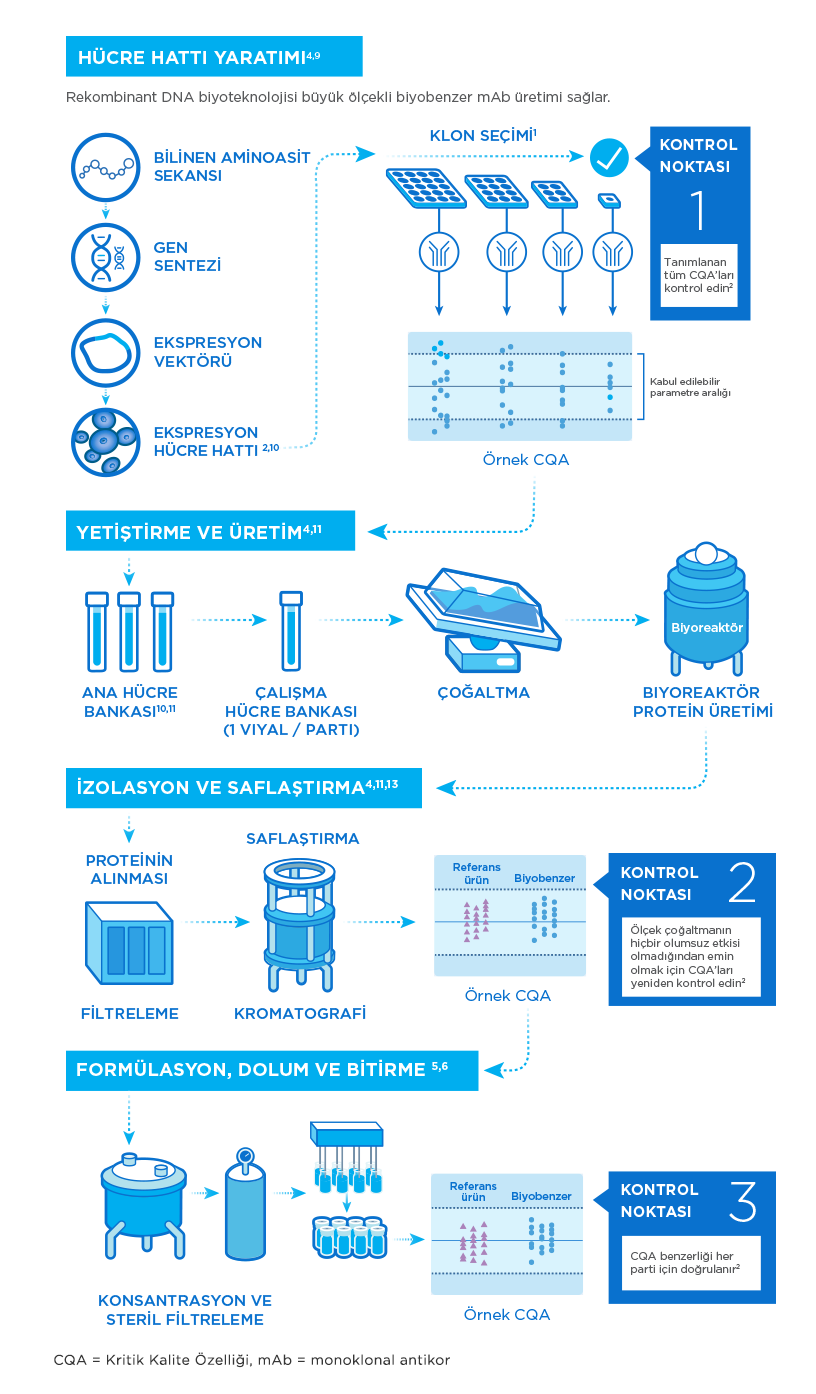
Biyolojik ilaçlarımız, büyük miktarda terapötik protein üretimi için tasarlanmış canlı hücreler kullanılarak üretilmektedir. Bu hücreler, sentezleme ve işleme esnasında oluşan koşullar karşısında çok hassaslardır ve dolayısıyla tutarlı ve yüksek kalitede etken madde üretmek için çeşitli kültürleme ve saflaştırma aşamaları gereklidir.8
Aşağıdaki adımlardan oluşan kapsamlı bir tarama süreci kullanılır:4,6-8
- Proses hattı gelişimi
- Hücre çoğaltılması
- Ürün
- Saflaştırma (çoklu adımlar)
- Virüs inaktivasyonu/temizliği
- Dolum
- Bitirme
- Ambalajlama ve depolama
- Kalite güvence ve karakterizasyon
- Stabilite testleri
Biyobenzer üretimin karmaşık yanları
Biyolojik ilaç üretiminin tüm karmaşık yanları biyobenzer ilaçlar için de geçerlidir. Ancak biyobenzer oluşturmanın da kendine has bazı karmaşık yanları vardır.
Referanslar: 1. Kozlowski S. US FDA perspectives on biosimilar biological products. Sunum Yeri: 2014 Biotechnology Technology Summit; June 13, 2014; Rockville, MD. www.ibbr.umd.edu/sites/default/files/public_page/Kozlowski%20-%20Biomanufacturing%20Summit.pdf. Erişim Tarihi: 24 Nisan 2018. 2. US Food and Drug Administration. Quality Considerations in Demonstrating Biosimilarity of a Therapeutic Protein Product to a Reference Product: Guidance for Industry. www.fda.gov/downloads/drugs/guidances/ucm291134.pdf. Yayınlanma Tarihi: Nisan 2015. Erişim Tarihi: 25 Nisan 2018. 3. US Food and Drug Administration. Scientific Considerations in Demonstrating Biosimilarity to a Reference Product: Guidance for Industry. www.fda.gov/downloads/drugs/guidances/ucm291128.pdf. Yayınlanma Tarihi: Nisan 2015. Erişim Tarihi: 20 Nisan 2018. 4. Desanvicente-Celis Z, Gomez-Lopez A, Anaya J-M. Similar biotherapeutic products: overview and reflections. Immunother. 2012;4:1841-1857. 5. Ramanan S, Grampp G. Drift, evolution, and divergence in biologics and biosimilars manufacturing. BioDrugs. 2014;28:363-372. 6. Bee JS, Randolph TW, Carpenter JF, Bishop SM, Dimitrova MN. Effects of surfaces and leachables on the stability of biopharmaceuticals. J Pharma Sci. 2011;100:4158-4170. 7. Conner J, Wuchterl D, Lopez M, et al. The biomanufacturing of biotechnology products. In: Shimasaki C, ed. Biotechnology Entrepreneurship: Starting, Managing, and Leading Biotech Companies. Waltham, MA: Academic Press; 2014:351-385. 8. Lybecker KM. The biologics revolution in the production of drugs. Fraser Institute. www.fraserinstitute.org/studies/biologics-revolution-in-the-production-of-drugs. Erişim Tarihi: 25 Nisan 2018. 9. Dranitsaris G, Amir E, Dorward K. Biosimilars of biological drug therapies. Drugs. 2011;71:1527-1536. 10. Liu HF, Ma J, Winter C, Bayer R. Recovery and purification process development for monoclonal antibody production. mAbs. 2010;2:480-499. 11. Mellstedt H, Niederwieser D, Ludwig H. The challenge of biosimilars. Ann Oncol. 2008;19:411-419. 12. Roger SD. Biosimilars: how similar or dissimilar are they? Nephrology. 2006;11:341-346. 13. Hesse F, Wagner R. Developments and improvements in the manufacturing of human therapeutics with mammalian cell cultures. Trends Biotechnol. 2000;18:173-180.